MODELLO ATOMICO DI THOMSON
Sir Joseph John Thomson OM PRS (18 December 1856 – 30 August 1940) was a British physicist and Nobel Laureate in Physics, credited with the discovery of the electron, the first subatomic particle to be discovered. Thomson atomic model, earliest theoretical description of the inner structure of atoms, proposed about 1900 by William Thomson (Lord Kelvin) and strongly supported by Sir Joseph John Thomson, who had discovered (1897) the electron, a negatively charged part of every atom.
Thomson Atommodell
Joseph John Thomson è stato un fisico britannico che nel 1896 dimostrò, attraverso una serie di esperimenti, che i raggi catodici erano costituiti da piccole particelle cariche negativamente che egli chiamava ‘corpuscoli’. Thomson ne definì la massa e la carica e solo successivamente questi ‘corpuscoli’ furono chiamati elettroni.
Subito dopo la scoperta dell’elettrone, Thomson, nel 1904, propose un modello atomico che fu definito modello a panettone in cui l’atomo veniva rappresentato come una distribuzione di carica positiva diffusa, contenente delle cariche negative disposte in maniera regolare, in anelli rotanti. Se consideriamo un panettone, i canditi rappresentano gli elettroni immersi in una pasta carica positivamente.
Questo modello propone quindi che le cariche negative siano in grado di neutralizzare la presenza delle cariche positive in cui sono immerse, stabilendo che l’atomo è neutro.

Thomson, così, rappresenta l’atomo non più come qualcosa di indivisibile, ma piuttosto come qualcosa di divisibile, in quanto costituito da particelle subatomiche, più piccole dell’atomo stesso.
MODELLO ATOMICO DI RUTHERFORD
Ernest Rutherford, chimico e fisico britannico, fece un esperimento che culminò con la confutazione del modello atomico a panettone proposto da Thomson. Egli dimostrò che l’atomo era costituito da un nucleo centrale in cui si concentrava la maggior parte della materia carica positivamente (nucleo atomico), intorno al quale ruotavano gli elettroni. Quindi, a differenza del modello atomico di Thomson in cui l’atomo è rappresentato come una sfera carica positivamente, in cui sono immersi gli elettroni, il modello atomico planetario di Rutherford propone un atomo ‘vuoto’ che concentra tutta la materia carica positivamente in un nucleo delimitato, attorno al quale ruotano gli elettroni.
ESPERIMENTO DI RUTHERFORD
L’esperimento di Rutherford aveva come scopo quello di confermare il modello atomico proposto da Thomson.
Questo esperimento prevedeva l’utilizzo di una sorgente radioattiva in grado di emettere particelle alfa che venivano sparate su una lamina d’oro.
Quello che ci si aspettava era che le particelle alfa, una volta entrate in contatto con la lamina d’oro, la attraversassero parallelamente o al più venissero leggermente deviate tutte allo stesso modo, data l’omogeneità dell’atomo. Quello che si osservò, invece, era che alcune particelle venivano deviate anche con angoli maggiori di 90°, tornando verso la fonte che le aveva generate.
L’ipotesi di Rutherford fu che l’atomo doveva essere costituito da una zona centrale di materia estremamente densa nonché carica, in grado di interrompere il decorso delle grandi particelle alfa, e addirittura in grado di farle rimbalzare.
Grazie a questo esperimento Rutherford è giunto alla conclusione che al centro dell’atomo vi fosse un nucleo denso e carico positivamente, che intorno ad esso ruotassero elettroni carichi negativamente in numero tale da neutralizzare la carica positiva e che tra il nucleo e gli elettroni ci fosse spazio vuoto.
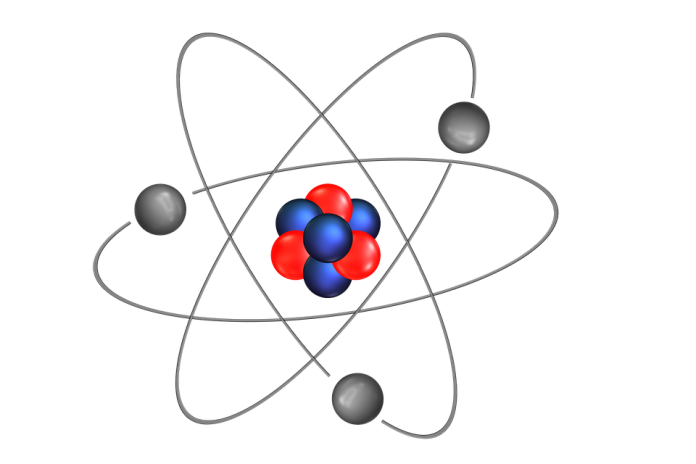
Questo modello non fu accettato completamente dalla comunità scientifica in quanto entrava in contrasto con la fisica classica secondo cui una particella carica accelerata emette energia sotto forma di radiazione elettromagnetica, perdendo energia. Gli elettroni che ruotano attorno al nucleo centrale perderebbero energia fino ad annichilire, ossia a collassare sul nucleo.
(Le immagini sono tratte da Wikipedia)
Potrebbero interessarti
MODELLO ATOMICO DI THOMSON
Joseph John Thomson è stato un fisico britannico che nel 1896 dimostrò, attraverso una serie di esperimenti, che i raggi catodici erano costituiti da piccole particelle cariche negativamente che egli chiamava ‘corpuscoli’. Thomson ne definì la massa e la carica e solo successivamente questi ‘corpuscoli’ furono chiamati elettroni.
Subito dopo la scoperta dell’elettrone, Thomson, nel 1904, propose un modello atomico che fu definito modello a panettone in cui l’atomo veniva rappresentato come una distribuzione di carica positiva diffusa, contenente delle cariche negative disposte in maniera regolare, in anelli rotanti. Se consideriamo un panettone, i canditi rappresentano gli elettroni immersi in una pasta carica positivamente.

Questo modello propone quindi che le cariche negative siano in grado di neutralizzare la presenza delle cariche positive in cui sono immerse, stabilendo che l’atomo è neutro.
Thomson, così, rappresenta l’atomo non più come qualcosa di indivisibile, ma piuttosto come qualcosa di divisibile, in quanto costituito da particelle subatomiche, più piccole dell’atomo stesso.
MODELLO ATOMICO DI RUTHERFORD
Ernest Rutherford, chimico e fisico britannico, fece un esperimento che culminò con la confutazione del modello atomico a panettone proposto da Thomson. Egli dimostrò che l’atomo era costituito da un nucleo centrale in cui si concentrava la maggior parte della materia carica positivamente (nucleo atomico), intorno al quale ruotavano gli elettroni. Quindi, a differenza del modello atomico di Thomson in cui l’atomo è rappresentato come una sfera carica positivamente, in cui sono immersi gli elettroni, il modello atomico planetario di Rutherford propone un atomo ‘vuoto’ che concentra tutta la materia carica positivamente in un nucleo delimitato, attorno al quale ruotano gli elettroni.
ESPERIMENTO DI RUTHERFORD
L’esperimento di Rutherford aveva come scopo quello di confermare il modello atomico proposto da Thomson.
Questo esperimento prevedeva l’utilizzo di una sorgente radioattiva in grado di emettere particelle alfa che venivano sparate su una lamina d’oro.
Quello che ci si aspettava era che le particelle alfa, una volta entrate in contatto con la lamina d’oro, la attraversassero parallelamente o al più venissero leggermente deviate tutte allo stesso modo, data l’omogeneità dell’atomo. Quello che si osservò, invece, era che alcune particelle venivano deviate anche con angoli maggiori di 90°, tornando verso la fonte che le aveva generate.

L’ipotesi di Rutherford fu che l’atomo doveva essere costituito da una zona centrale di materia estremamente densa nonché carica, in grado di interrompere il decorso delle grandi particelle alfa, e addirittura in grado di farle rimbalzare.
Grazie a questo esperimento Rutherford è giunto alla conclusione che al centro dell’atomo vi fosse un nucleo denso e carico positivamente, che intorno ad esso ruotassero elettroni carichi negativamente in numero tale da neutralizzare la carica positiva e che tra il nucleo e gli elettroni ci fosse spazio vuoto.

Questo modello non fu accettato completamente dalla comunità scientifica in quanto entrava in contrasto con la fisica classica secondo cui una particella carica accelerata emette energia sotto forma di radiazione elettromagnetica, perdendo energia. Gli elettroni che ruotano attorno al nucleo centrale perderebbero energia fino ad annichilire, ossia a collassare sul nucleo.
Thompson Automotive Nh
(Le immagini sono tratte da Wikipedia)
Thomson Atom Model
Potrebbero interessarti
